¿Átomo?
Unidad estructural de todo elemento que mantiene sus propiedades o identidad. En el átomo están presentes los electrones, protones y neutrones. Estos, se dividen de la siguiente manera, los neutrones con los protones conforman el núcleo, mientras que los electrones giran a través del núcleo a una alta velocidad.
Esta unidad básica fue descubierto en grecia, por el conocido filósofo-matemático Demócrito.
Estructura Interna del atomo

Partículas elementales

Modelos atómicos
Las partículas elementales presente en un atomo son:
Protón (núcleo)
Partícula con carga postiva ubicada dentro del nucle en el átomo.
Partícula sin carga. Ubicada en el núcleo.
Electrón (corteza)
Partícula cargada negativamente que rodea en nucleo.

Modelos atómicos
1. Modelo Atómico de Dalton
John Dalton fue un Químico-matemático ingles que desde pequeño se dedico a la investigación de la ciencia.
Su modelo atómico fue expuesto en un libro llamado “Nuevo sistema de filosofía química” en la cual dejaba planteado sus postulados que decían así:
- La materia está formada por partículas pequeñísimas llamadas “átomos”.
- Estos átomos no se pueden dividir ni romper, no se crean ni se destruyen en ninguna reacción química, y nunca cambian.
- Los átomos de un mismo elemento son iguales entre sí, tienen la misma masa y dimensiones; por ejemplo, todos los átomos de hidrógeno son iguales.
- Por otro lado, los átomos de elementos diferentes, son diferentes; por ejemplo, los átomos de oxígeno son diferentes a los átomos de hidrógeno.
- Los átomos pueden combinarse para formar compuestos químicos. Por ejemplo, los átomos de hidrógeno y oxígeno pueden combinarse y formar moléculas de agua.
- Los átomos, al combinarse para formar compuestos guardan relaciones simples.
- Los átomos de elementos diferentes se pueden combinar en proporciones distintas y formar más de un compuesto. Por ejemplo, un átomo de carbono con uno de oxígeno forman monóxido de carbono (CO), mientras que dos átomos de oxígeno con uno de carbono, forman dióxido de carbono (CO2)

 Fue un Físico-químico nacido en
Reino Unido en el año 1856. Demostró que dentro de los átomos hay unas
partículas diminutas, con carga eléctrica negativa, a las que se llamó electrones. De este descubrimiento
dedujo que el átomo debía de ser una esfera de materia cargada positivamente,
en cuyo interior estaban incrustados los electrones (Modelo conocido
vulgarmente como BUDIN DE PASAS).
Fue un Físico-químico nacido en
Reino Unido en el año 1856. Demostró que dentro de los átomos hay unas
partículas diminutas, con carga eléctrica negativa, a las que se llamó electrones. De este descubrimiento
dedujo que el átomo debía de ser una esfera de materia cargada positivamente,
en cuyo interior estaban incrustados los electrones (Modelo conocido
vulgarmente como BUDIN DE PASAS).
Con las informaciones de las que
se disponía en esa época, presento algunas hipótesis entre 1898 y 1904 en un
intento de justificar dos hechos relativos.
- Que la materia es eléctricamente neutra, esto permitiría pensar que aparte de electrones, es posible que hayan partículas con cargas positivas.
- Es posible extraer electrones de los átomos, pero no del mismo modo las cargas positivas.
El modelo que propuso consistía en que
el átomo estaba formado por una masa cargada eléctricamente positiva en la cual
se incrustaban electrones.

3.
Modelo Atómico de Ernest Rutherford
 Fue un destacado Físico nacido en Nueva Zelanda. En sus trabajos e investigaciones demostró que los átomos no eran macizos, como se creía, sino que están vacíos en su mayor parte y en su centro hay un diminuto núcleo. De este descubrimiento dedujo que el átomo debía de ser una esfera de materia cargada positivamente, en cuyo interior estaban incrustados los electrones.
Fue un destacado Físico nacido en Nueva Zelanda. En sus trabajos e investigaciones demostró que los átomos no eran macizos, como se creía, sino que están vacíos en su mayor parte y en su centro hay un diminuto núcleo. De este descubrimiento dedujo que el átomo debía de ser una esfera de materia cargada positivamente, en cuyo interior estaban incrustados los electrones.
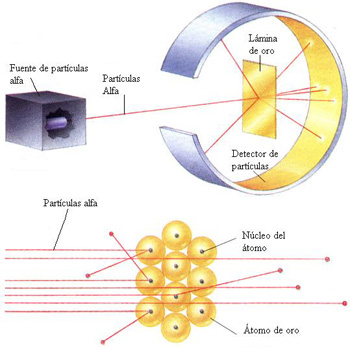
Procedimiento:
Rutherford envio rayos alfas (cargados positivamente) hacia una
delgada lamina de oro. Alrededor
de la lamina coloco una pantalla circular fluorescente, la que permitió poder llegar a un resultado que destronaria el modelo atómico de J.J Thomson.
- Habían rayos alfas que se desviaban, otros rebotaban y otros que pasabn sin tener alteración alguna.
Con este resultado, Ruterford saca conclusiones y da a conocer su modelo atómico.
4. Modelo atómico de Niels Bohr
Fue un
Físico nacido en Dinamarca el año 1885. Realizo grandes aportes a la contribución de la comprensión del átomo y
la mecánica cuántica.
 Luego
de estudiar en Inglaterra publica su libro llamado "modelo atómico de Bohr", en el cual tomo como base de
su modelo, el modelo de Rutherford.
Luego
de estudiar en Inglaterra publica su libro llamado "modelo atómico de Bohr", en el cual tomo como base de
su modelo, el modelo de Rutherford.
Los
postulados de Bohr fueron los siguientes:
1) Un átomo posee un determinado número de órbitas
estacionarias, en las cuales los electrones no radian ni absorben energía,
aunque estén en movimiento.
2) El electrón gira alrededor de su núcleo de tal forma que la fuerza centrífuga sirve para equilibrar con exactitud la atracción electrostática de las cargas opuestas.
3) El electrón solo emite o absorbe energía en los saltos de una órbita permitida a otra.
2) El electrón gira alrededor de su núcleo de tal forma que la fuerza centrífuga sirve para equilibrar con exactitud la atracción electrostática de las cargas opuestas.
3) El electrón solo emite o absorbe energía en los saltos de una órbita permitida a otra.

Isótopos
Este concepto se le designa a los átomos que son de un mismo elemento que contienen diferentes números de neutrones en su núcleo. Por ejemplo el Neón posee un Z=10, todos tienen diez protones en su núcleo, solo varía el numero de neutrones, es decir, son todos isótopos del Neón.
Otro ejemplo es el Hidrógeno, el cual tiene tres isótopos que son de la siguiente forma:

Enlace Químico
El enlace químico es la fuerza que mantiene unidos a los átomos (enlace interatómico) para formar moléculas o formar sistemas cristalinos (iónicos, metálicos o covalentes) y moléculas (enlace intermolecular) para formar los estados condensados de la materia (sólido y líquido), dicha fuerza es de naturaleza electromagnética (eléctrica y magnética), predominante fuerza eléctrica.
Tipos de enlace Interatómicos.
- Enlace Iónico
- Enlace Covalente
- Enlace Metalico
Enlace Iónico
El enlace iónico es la fuerza de atracción eléctrica que existe entre los iones de cargas o puestas (cationes – aniones) que los mantienen juntos en una estructura cristalina. Resulta de la transferencia de uno o mas electrones comúnmente del metal hacia el no metal.

Características
- A temperatura ambiental son sólidos, cuya estructura está definida por lo que son cristalinos (la atracción de los iones es polidireccional).
- Generalmente son solubles en agua y otros solventes polares como etanol, acetona, etc.
- Tienen alta temperatura de fusión y ebullición.
Enlace Covalente
Es la fuerza electromagnética que mantiene unidos a átomos que comparten electrones, los cuales tienen espines o giros opuestos. Los átomos enlazados se encuentran neutros y generalmente son no metálicos.

Características
- A temperatura ambiental pueden ser sólidos, líquidos o gaseosos.
- Algunos pueden ser sólidos cristalinos
- Generalmente tienen baja temperatura de fusión y ebullición.
- Generalmente son insolubles en agua, pero si son solubles en solventes apolares
- Son aislantes, es decir, son malos conductores eléctricos.
Enlace Metálico (Ver animación)
Los átomos de los metales tienen pocos electrones en su última capa, por lo general 1, 2 ó 3. Éstos átomos pierden fácilmente esos electrones (electrones de valencia) y se convierten en iones positivos, por ejemplo Na+, Cu2+, Mg2+. Los iones positivos resultantes se ordenan en el espacio formando la red metálica. Los electrones de valencia desprendidos de los átomos forman una nube de electrones que puede desplazarse a través de toda la red. De este modo todo el conjunto de los iones positivos del metal queda unido mediante la nube de electrones con carga negativa que los envuelve.

Características
- Temperaturas de fusión y ebullición muy elevadas. Son sólidos a temperatura ambiente (excepto el mercurio que es líquido).
- Buenos conductores de la electricidad (nube de electrones deslocalizada) y del calor (facilidad de movimiento de electrones y de vibración de los restos atómicos positivos).
- Son dúctiles (facilidad de formar hilos) y maleables (facilidad de formar láminas) al aplicar presión. Esto no ocurre en los sólidos iónicos ni en los sólidos covalentes dado que al aplicar presión en estos caso, la estructura cristalina se rompe.
- Son en general duros (resistentes al rayado).
- La mayoría se oxida con facilidad.
Radioactividad
En 1896, el físico alemán Henri Becquerel observó de casualidad éste fenomeno por primera vez. Descubrió que los minerales de uranio podían de velar una placa fotográfica en ausencia de luz externa, por lo que concluyó que poseían la propiedad de emitir radiaciones en forma espontánea.
Luego de éste descubrimiento, la química polaca Marie Curie y su esposo francés, Pierre Curie, comprobaron que todos los minerales de uranio las emitían y además aislaron otros dos elementos con idénticas propiedades, el polonio y el radio, a los que llamaron elementos radioactivos.
Como la radioactividad no puede ser persibida por los sentidos, se creó un aparto llamado Contador Geiger-Muller, el cual mide la radioactividad del material hacia el exterior.
Decaimiento radioactivo
Los átomos con el propósito de liberar radiación para corregir la diferencia que hay en su núcleo entre protones y neutrones se conoce como decaimiento radioactivo. Éste fenómeno ocurre cuando los átomos tiende a ser átomos estables.
Rutherford con uno de sus experimentos se dio cuenta que los átomos eran capaces de emitir tres tipos de radiaciones: ALFA (+), BETA (-) Y GAMA(neutro).

Vida Media de los elementos radioactivos
La vida media de los elementos radioactivos es el tiempo que tarda en desintegrarse la mitad de los núcleos de éstos elementos en relación a su valor inicial. Esto se conoce también como el "Periodo de semidesintegración".
Ejemplo: Ra-226
Si midiéramos 226 g de este isótopo, y lo dejáramos en una mesa; luego de 1600 años volver y determinar la cantidad de radio que queda.
El resultado sería que solo queda 113 g de Radio. Ya que el decaimiento radiactivo del radio es de cada 1600 años la cantidad de radio disminuye a la mitad, ya que la otra mitad ya fue emitida al exterior.
Efectos de la Radioactividad en los seres humanos
Los seres humanos estamos constantemente expuesto a distintos tipos de radiación, ya sea electromagnética o de partículas. Las radiaciones que nos afectan, más de un 75% de estas son naturales, ya sean los rayos ultravioletas, radiación infrarroja del sol como la radiación del gas rodón. El otro 25% aprox. restante proviene de fuentes artificiales, como son las ondas de radio, rayos X, entre otros.
Estos tipos de radiación son peligrosos para la salud, ya que por ejemplo, algunas radiaciones de gama, alfa o beta pueden alterar el mecanismo regulador de crecimiento de las células, lo que produce la reproducción sin control de éstas, produciendo cáncer.
Las radiaciones generalmente afectan a nivel genético, ya sea produciendo malformaciones de los genes, lo que produce la conocida enfermedad llamada Mutación. También afecta a los descendientes de las personas expuestas a radiación, teniendo graves problemas los descendientes de aquellas personas.
Factores del daño a producir de una radiación:
- Tipo de radiación.
- Dosis.
- Tiempo de exposición.
- Tipo de tegido afectado.
- Sencibilidad individual.


Cuando en la naturaleza existe radiación, el núcleo de desintegra espontáneamente liberando emisiones radioactivas y transformándose en un núcleo diferente, esto se conoce como radioactividad natural.
Al igual que en la radiactividad natural, este proceso genera cambios en la naturaleza del núcleo, es decir, se produce una transmutación nuclear donde un núcleo se transforma en otro y se libera energía. Las reacciones de este tipo han permitido sintetizar cientos de radioisótopos los que se utilizan en medicina, en la investigación científica, en la agricultura y en muchas otras áreas.
En la radiactividad inducida intervienen cuatro partículas: un núcleo objetivo, una partícula que bombardea, un núcleo producto y una partícula expulsada. Las partículas más utilizadas para bombardear núcleos, y así obtener diferentes isótopos, son los neutrones. Al tener carga neutra, evitan la repulsión entre la partícula y el núcleo, facilitando de este modo la interacción.
Tipos de radioactividad inducida
Fisión y fusión nuclear
La fisión nuclear consiste en la rotura de núcleos de átomos “grandes” mediante bombardeo con neutrones, dando lugar a dos o más núcleos de átomos “pequeños” y algunas otras partículas. Además se libera gran cantidad de energía.
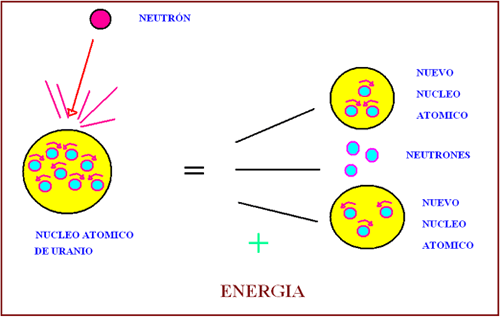 El proceso comienza al bombardear el núcleo grande con partículas como neutrones. (Los neutrones son buenos proyectiles ya que al no tener carga son menos rechazados por parte del núcleo). Además de núcleos de elementos con átomos más pequeños, se liberan otros neutrones que rompen otros núcleos grandes, en lo que se denomina una reacción en cadena.
El proceso comienza al bombardear el núcleo grande con partículas como neutrones. (Los neutrones son buenos proyectiles ya que al no tener carga son menos rechazados por parte del núcleo). Además de núcleos de elementos con átomos más pequeños, se liberan otros neutrones que rompen otros núcleos grandes, en lo que se denomina una reacción en cadena.La gran cantidad de energía que se libera se llama energía nuclear. Esta energía se aprovecha en las centrales nucleares para obtener energía eléctrica. También es la responsable del efecto destructivo de las bombas atómicas y de los misiles nucleares.
La fusión nuclear es un proceso en el que núcleos de átomos muy pequeños se unen para dar núcleos de átomos mayores. Este metodo es usado para generar bombas atómicas de tipo H (Bombas de hidrógenos) y se investiga de que forma se podria ocupar para poder ocuparla como energía de uso civil.
Aplicacones de radioisótopos
Los Radioisótopos son isótopos radiactivos de un elemento. Por ejemplo, el 3H es un isótopo radiactivo del 1H.
Algúnas aplicaciones:
1. Irradiación de alimentos: La irradiación gamma proviene de fuentes de Co-60 o Cs-137. es un medio que reduce la descomposición de los alimentos, sin que se torne radiactivo. La pasteurización con gamma retarda el crecimiento de bacterias, mohos y levaduras.
2. En medicina permite la visualización por contraste de organos, tumores, funciones anormales, pasos metabolicos y terapica onmcológica.
La radioterapia Interna consiste en introducir al cuerpo del paciente la fuente emisora de radiación por via oral o via sanguínea.

3. Aplicaciones Nucleares: En las Centrales nucleares se obtienen grandes cantidades de energía aprovechando la fisión de ciertos isótopos. Los isótopos más empleados en estas centrales son el uranio-235 y el plutonio-239.
Otra de las formas de aprovechamiento de la energía nuclear, es en la fabricación de pilas de muy larga duración. Uno de los isótopos más empleados es el plutonio-238. Estas pilas se colocan en lugares de difícil acceso o que no pueden ser cambiadas con frecuencia, como por ejemplo: en marcapasos, en estaciones marítimas o en sondas espaciales.
Los radioisótos también se pueden ocupar para diagnosticar algunas enfermedades, se introduce en los enfermos (bebiendo o inyectando un líquido) una sustancia que contiene un isótopo radiactivo que emita radiación con poca energía. La sustancia se fija en el órgano que se desea estudiar y, así, se puede observar, por la radiación que emite. La radiación se detecta con aparatos como la cámara de rayos gamma. Por ejemplo, el tecnecio-99 se emplea en el diagnóstico de enfermedades óseas. Para ello se suministra con compuestos de fósforo que se fijan en los huesos.
Aplicaciones Bélicas
Una bomba atómica es un dispositivo que obtiene una gran cantidad de energía de reacciones nucleares. Su funcionamiento se basa en provocar una reacción nuclear en cadena descontrolada.
Su procedimiento se basa en la fisión de un núcleo pesado en elementos más ligeros mediante el bombardeo de neutrones que, al impactar en dicho material, provocan una reacción nuclear en cadena. Para que esto suceda hace falta usar núcleos fisibles o fisionables como el uranio-235 o el plutonio-239.
Su procedimiento se basa en la fisión de un núcleo pesado en elementos más ligeros mediante el bombardeo de neutrones que, al impactar en dicho material, provocan una reacción nuclear en cadena. Para que esto suceda hace falta usar núcleos fisibles o fisionables como el uranio-235 o el plutonio-239.